Forschungsbereich A: Krankheitsmechanismen
-
TP A01: Audiogenetische Klinik Göttingen: Klinische, genetische und funktionelle Charakterisierung neuartiger Schwerhörigkeits-Gene
(Nicola Strenzke / Bernd Wollnik)
Wir kombinieren die detaillierte klinische Phänotypisierung von Patienten mit Schwerhörigkeit mit NGS-basierter Panel-Sequenzierung und interdisziplinärer Beratung sowie Exom- und Short/Long-Read-Genom-Sequenzierung, um mindestens fünf neue Kandidaten für Schwerhörigkeits-Gene zu identifizieren. Diese untersuchen wir funktionell in Mausmodellen. Beispielsweise haben wir kürzlich eine Mutation in CACHD1 bei einem Patienten mit Hörmüdigkeit identifiziert, die wir in vitro und in vivo in einem neuen Mausmodell weiter charakterisieren werden, um die Rolle von CACHD1 bei der Schallkodierung im Innenohr besser zu verstehen.
-
TP A02: Haarzell-CaV1.3-Kanalopathien: Krankheitsmechanismen und präklinische Entwicklung gentherapeutischer Ansätze
(Tina Pangršič Vilfan / Eri Sakata)
Ca2+-Einstrom durch spannungsgesteuerte CaV1.3-Kanäle vermittelt die synaptische Übertragung an der ersten Synapse der Hörbahn. Die Aktivität der CaV1.3-Kanäle wird durch verschiedene Faktoren reguliert, darunter Calmodulin und calciumbindende Proteine (CaBPs). Pathologische Mutationen von CaBP2 oder dem Kanal selbst wurden als Ursache für nicht-syndromale oder syndromale Hörstörungen bei Patienten identifiziert. Wir werden Biochemie und Strukturbiologie, Krankheitsmodellierung bei Mäusen und Elektrophysiologie kombinieren, um Struktur und Funktion von CaV1.3 und CaBPs in gesunden und erkrankten Ohren zu untersuchen und gentherapeutische Ansätze zur Behandlung von CaBP2-bezogenen Kanalopathien zu entwickeln.
-
TP A03: Otoferlin-assoziierte auditorische Synaptopathie: In vitro Analyse der Krankheitsmechanismen
(Julia Preobraschenski / Barbara Vona)
Auditorische Synaptopathie ist ein wichtiger Schwerhörigkeits-Mechanismus, der am häufigsten durch Varianten von Otoferlin entsteht, deren Pathophysiologie allerdings mangels genetischer und biophysiologischer Analysen auf mRNA- und Proteinebene noch unklar ist. Wir werden die unterschätzten Auswirkungen von Splicevarianten erforschen und ein heterologes System anwenden, um die Expression zu bewerten. Stabil exprimierende Mutanten werden aufgereinigt, um deren Ca2+-, Phospholipid- und Proteinbindungseigenschaften und die Struktur von nahe-nativem und detergenz-stabilisiertem Otoferlin zu untersuchen. Unser Ziel ist ein detailliertes Verständnis der durch schädliche Otoferlin-Varianten verursachten menschlichen Phänotypen.
-
TP A04: Otoferlin-assoziierte auditorische Synaptopathie: Krankheitsmechanismen und präklinische Entwicklung von gentherapeutischen Ansätzen
(Kathrin Kusch / Tobias Moser)
Synaptische Krankheitsmechanismen tragen zur Schallempfindungsschwerhörigkeit bei, wobei Otoferlin-Mutationen die häufigste Ursache der vererbten auditorischen Synaptopathie sind. Dieses Projekt zielt darauf ab, die Otoferlin-bedingte Synaptopathie durch eine umfassende Analyse der gestörten synaptischen Schallkodierung in CRISPR/Cas9-Mausmodellen von menschlichen Missense-Mutationen zu entschlüsseln. Parallel dazu planen wir die Verbesserung der viralen Gentherapie zur Wiederherstellung des Hörvermögens durch Erhöhung der verbleibenden Otoferlin-Expression.
-
TP A05: Untersuchung der Mechanismen der altersbedingten Synaptopathie im Maus-Utriculus
(Carolin Wichmann / Silvio-Olivier Rizzoli)
Alterung ist ein wichtiger Faktor bei sensorischen Störungen und besonders relevant für vestibuläre Dysfunktion, die bisher kaum untersucht wurde. Wir konzentrieren uns auf die sensorischen vestibulären Haarzellen (VHZ) und deren Exozytose an den Ribbonsynapsen. Wir haben die Reifung dieser Synapsen in der Maus untersucht und wollen nun mithilfe von Mäusen mit defekter VHZ-Exozytose die Auswirkungen von Altern und Aktivität auf das System im Detail untersuchen, um (i) die Auswirkung der Aktivität auf die VHZ-Synapse, (ii) das Verhalten von VHZ-Ribbonsynapsen in alternden Mäusen, (iii) die physiologische Rolle nicht-verankerter Ribbons und (iv) die Unterschiede im Umsatz der Bänder zwischen Typ I und II VHZs zu untersuchen.
-
TP A06: Pathomechanismen von sensorischen Defekten im Auge bei Autoimmunerkrankungen der grauen und weißen Substanz
(Francesca Odoardi / Alexander Flügel)
Das Ziel von A06 ist die Untersuchung der Auswirkungen von Autoimmunentzündungen auf das Auge. Bei ZNS-Autoimmunkrankheiten wie Multipler Sklerose ist das Auge häufig Ziel von Entzündungsprozessen, die zu strukturellen Schäden an Netzhaut und Sehnerv führen. Die Mechanismen, die Entzündung und Neurodegeneration in den verschiedenen Augenkompartimenten verbinden, sind noch unklar. Wir haben experimentelle Modelle entwickelt, um selektiv Autoimmunentzündungen in Netzhaut oder Sehnerv auszulösen, um die Auswirkungen auf das Auge zu beobachten. Wir verfolgen die Entzündungsprozesse im Auge in Echtzeit und charakterisieren die molekularen Schädigungsmechanismen, um gezielte therapeutische Strategien zu ermöglichen.
-
TP A07: Optimierung der Stimulation von Netzwerken ohne Input zur Wiederherstellung und Aufrechterhaltung ihrer Funktion
(Viola Priesemann / Andreas Neef)
Die Dynamik neuronaler Netzwerke ändert sich auf verschiedenen Zeitskalen nach Regeln, die wir erst ansatzweise verstehen. Modelle zeigen, dass dieselben Plastizitätsmechanismen, die normalerweise die Netzwerkfunktion adjustieren, infolge von Trauma oder Deafferenzierung zu pathologischer Aktivität führen können, wie Phantomempfindungen oder Burst-Aktivität. Wir untersuchen die Auswirkungen von Input-Entzug in silico und in vitro, um zu verstehen, wie wir inhärente Plastizität und Input gemeinsam nutzen können, um Systeme aus ihrer Isolation zu befreien. Unser Ziel ist es, dadurch natürlichere in vitro-Assays zu gestalten und durch fehlenden Input verursachte in vivo-Pathologien besser behandeln zu können.
Forschungsbereich B: Funktionelle Wiederherstellung
-
TP B01: Innovative optogenetische Stimulation der Hörbahn von Nagetieren
(Thomas Mager / Tobias Moser)
Wenn das Gehör versagt, können Cochlea-Implantate (CIs) das defekte Sinnesorgan umgehen und den Hörnerv elektrisch stimulieren. Die breite Stromausbreitung von den Elektrodenkontakten führt jedoch zu einer schlechten Frequenzkodierung. Da Licht räumlich besser begrenzt werden kann, verspricht die optogenetische Aktivierung von Spiralganglionneuronen (SGN) mit oCIs eine bessere Frequenzkodierung. Die Kodierung von Zeit- und Intensitätsinformationen durch optogenetische SGN-Stimulation bleibt jedoch noch hinter der physiologischen Schallkodierung zurück. Wir planen daher, die Kodierung von Zeit- und Intensitätsinformationen durch Zwei-Farben-Optogenetik zu verbessern.
-
TP B02: Modellierung und Regeneration des Innenohrs durch menschliche Otische Organoide
(Maria Patapia Zafeiriou / Christian Wrobel)
Der fortgeschrittene Verlust von auditorischen Haarzellen (HC) kann durch direkte Stimulation von Spiralganglionneuronen (SGN) über Cochlea-Implantate (CI) behandelt werden. Leider beeinträchtigt die Degeneration der SGN bei HC-Verlust die Leistung des CIs erheblich und schränkt somit die Rehabilitation des Hörvermögens ein. Dieses Projekt zielt darauf ab, neuartige Therapien für die Innenohrregeneration zu entwickeln, die Gentherapie- und Zelltransplantationsansätze umfassen. Dabei werden aus menschlichen induzierten pluripotenten Stammzellen erzeugte Ohrorganoide als präklinisches Krankheitsmodell, Screening-Plattform für therapeutische Anwendungen und als Zellquelle für die Transplantation genutzt.
-
TP B03: Gestaltung der optogenetischen Kontrolle von Populationen spiraler Ganglionneuronen für maximalen auditiven Informationsfluss
(Fred Wolf)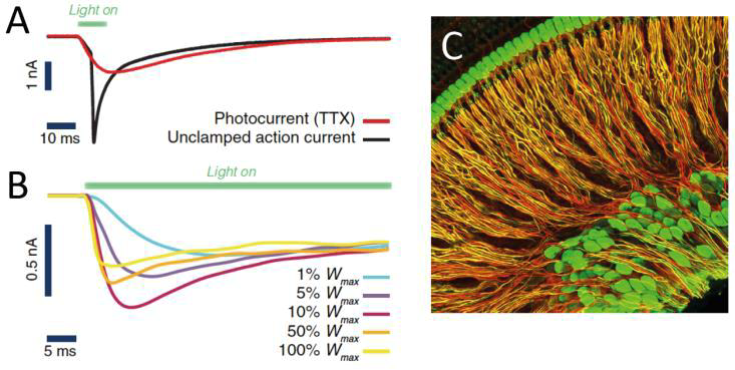
Optogenetische Cochlea-Implantate (oCIs), die eine verbesserte Frequenzspezifität der Stimulation ermöglichen, versprechen große Fortschritte bei CI-basierten Behandlungen. Möglichkeiten, unterschiedlich empfindliche Subpopulationen von Spiralganglionneuronen (SGNs) anzusprechen und die zeitliche Präzision ihrer optischen Steuerung zu optimieren, sind weitgehend unerforscht. Aufbauend auf unseren Arbeiten zur dynamischen Populationskodierung, zur Modellierung der auditorischen Verarbeitung und zur Optimierung neuronaler Systeme schlage ich rechnerische und theoretische Arbeiten zur Optimierung der zeitlichen Präzision der Steuerung der SGN-Aktivität vor.
-
TP B04: Hören und Kommunizieren mit optogenetischen und elektrischen Cochlea-Implantaten bei Weißbüschelaffen
(Marcus Jeschke)
Über 5 % der Weltbevölkerung leiden an hochgradigem Hörverlust. Elektrische Cochlea-Implantate (eCIs) ermöglichen eine teilweise Wiederherstellung des Hörens, haben jedoch eine schlechte Frequenzauflösung. Dieses Projekt untersucht das Potenzial optogenetischer Cochlea-Implantate (oCIs), dieses Problem zu überwinden. An Weißbüschelaffen werden wir Verhaltens- und elektrophysiologische Ansätze nutzen, um die Verarbeitung von mehrkanaliger optogenetischer Cochlea-Stimulation und Cochlea-Implantat-codierten Vokalisationen zu untersuchen. Das übergeordnete Ziel ist dabei der Vergleich der Hörwiederherstellungskapazitäten von eCIs und oCIs in komplexen Hör- und Kommunikationssituationen.
-
TP B05: Auf dem Weg zur optogenetischen Wiederherstellung der natürlichen Netzhautaktivität
(Tim Gollisch)
Um durch Degeneration der Fotorezeptoren verlorenes Sehvermögen wiederherzustellen, können überlebende Neuronen in der Retina durch Optogenetik gezielt stimuliert werden. Wie ähnlich diese künstlich hervorgerufene Aktivität zur natürlichen ist, ist jedoch nicht bekannt. Eine Nachbildung der natürlichen Aktivität könnte möglich sein, indem mittels Computermodellen optogenetische Stimulationsmuster optimiert werden. Wir werden die Reaktionen retinaler Ganglienzellen auf natürliche und optogenetische Lichtstimulation vergleichen und beurteilen, inwieweit Verarbeitung und Funktion der Schaltkreise unter optogenetischer Stimulation erhalten bleiben und welche Anpassungen helfen können, um natürliche Aktivitätsmuster nachzubilden.
-
TP B06: Untersuchung der Auswirkungen der durch Blindheit verursachten Gehirnplastizität auf die optogenetische Wiederherstellung des Sehvermögens
(Emilie Macé)
Optogenetische Netzhauttherapie verspricht eine allgemein anwendbare Lösung zur Wiederherstellung verlorenen Sehvermögens. Allerdings verursacht früh einsetzende Blindheit eine signifikante Umorganisation des Gehirns, was Therapieergebnisse beeinträchtigen kann. Mit funktioneller Ultraschall-Bildgebung werden wir durch Blindheit induzierte Plastizität in Modellen für früh und spät einsetzende Blindheit charakterisieren. Wir nutzen ein Opsin, das bei normalem Licht aktivierbar ist, und werden mit naturalistischen Reizen untersuchen, wie diese Hirnveränderungen die visuelle Wahrnehmung nach der Behandlung beeinflussen. Dies wird neue Erkenntnisse über die Plastizität des Gehirns liefern und zur Optimierung zukünftiger Therapien beitragen.
-
TP B07: Bewertung der gentherapeutischen Mikrotubuli-Stabilisierung zur Wiederherstellung von Axonen im verletzten fertig entwickelten Rückenmark
(Frank Bradke)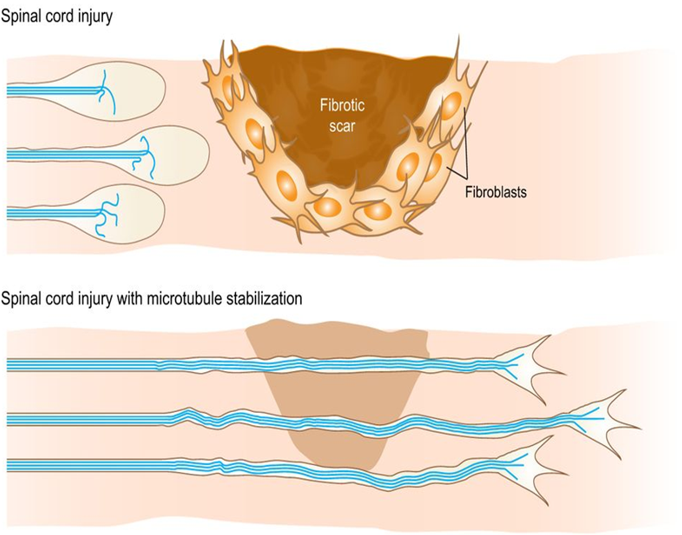
Nach einer Verletzung des Zentralnervensystems können sich Axone aufgrund neuronen-interner und -externer Prozesse nicht regenerieren. Die pharmakologische Stabilisierung von Mikrotubuli induziert die Axonregeneration, indem sie die Axonwachstumskompetenz reaktiviert und die fibrotische Vernarbung hemmt, was zu einer funktionellen Erholung nach einer Rückenmarksverletzung führt. Wir werden Tubulin-Tyrosin Ligase in Neuronen und narbenbildenden Zellen in rückenmarksverletzten Mäusen aus- und abschalten und das Nachwachsen von Axonen, Veränderungen der Narbenbildung und die funktionelle Erholung untersuchen.
-
TP B08: Aufklärung der inhibitorischen top-down Kontrolle des motorischen kortikalen Outputs für fortgeschrittene bidirektionale neuronale Schnittstellen
(Ilka Diester)
Primäre motorische und prämotorische Kortexe setzen motorische Pläne in Befehle um und spielen eine entscheidende Rolle für Gehirn-Maschine-Schnittstellen (BCI). Ihre Interaktionen, insbesondere die Beeinflussung der primären motorischen Areale durch prämotorische Areale während der Bewegungsplanung und -ausführung, sind nach wie vor unklar. Unsere Forschung hat gezeigt, dass der prämotorische den primären motorischen Kortex während der Planung über Parvalbumin-positive Interneuronen hemmt. Wir werden diesen Signalweg bei Mäusen mit modernsten Techniken untersuchen um das Verständnis der interarealen Kommunikation zu verbessern und eine präzise Feedback-Stimulation für BCIs zu ermöglichen.
-
TP B09: Multisensorisches Feedback für das Lernen der Steuerung von Gehirn-Computer-Schnittstellen
(Alexander Gail)
Gehirn-Computer-Schnittstellen (BCIs) können neuroprothetische Geräte steuern, um motorische Funktionen wiederherzustellen. Wir wollen BCIs durch sensorisches Feedback verbessern und werden Kontrolle und Anpassung von BCI-gesteuerten Bewegungen durch visuelles und vibrotaktiles Feedback in chronischen intrakortikalen Aufzeichnungen aus Rhesusaffen untersuchen, die ihre Handposition in virtueller Realität über ein Closed-Loop-BCI steuern. Parallel dazu werden wir psychophysische Experimente mit Menschen und Affen durchführen, um die vibrotaktile Stimulation und die visuell-taktile Integration zu optimieren. Ziel ist die Entwicklung von Dekodierungsalgorithmen, die schnelle und präzise neuroprothetische Steuerung ermöglichen.
-
TP B10: Bi-direktionale neuronale Schnittstellen für das Greifen mit der Hand und sensorisches Feedback
(Hansjörg Scherberger)
Gelähmte Patienten könnten von neuronalen Schnittstellen profitieren, die motorische Befehle an eine Handprothese übertragen, welche taktile Informationen als somatosensorisches Feedback an das Gehirn zurücksendet. Wir schlagen vor, bei Makaken die Dekodierung von Hand- und Fingerbewegungen aus der Aktivität der prämotorischen und motorischen Kortexpopulation mit der Übermittlung taktiler Informationen von der Roboterhand an den sensorischen Kortex durch elektrische Stimulation zu kombinieren. So werden wir eine bidirektionale neuronale Schnittstelle für das Greifen mit der Hand schaffen, die eine bessere Kontrolle über die Hand ermöglichen soll als derzeitige unidirektionale Schnittstellen.
-
TP B11: Optogenetische laryngeale Schrittmacherfunktion
(Tobias Brügmann / Dirk Beutner)
Eine Lähmung des Rekurrensnervs, der den Kehlkopf innerviert, führt zu Stimmbandstarre und behindert die Stimme sowie Luftdurchgang durch den Kehlkopf. Patienten können derzeit nur mit destruktiven chirurgischen Eingriffen behandelt werden, da elektrische Stimulation antagonistische Muskeln und sensorische Nerven mitstimuliert. Optogenetik erlaubt die muskelzellenspezifische und räumlich hochaufgelöste Stimulation. Wir werden in vitro in Myotuben und in vivo in Mäusen den Gentransfer von Channelrhodopsin (ChR) weiterentwickeln, ChR-Varianten testen und die Immunantwort charakterisieren und den optogenetischen Kehlkopfschrittmache in Schweinen testen, sowie optische Implantate entwickeln und charakterisieren.
Zentrale Teilprojekte
-
TP INF: Zentrale Datenplattform für sensorische und motorische Neurowissenschaften
(Dagmar Krefting / Bernd Wollnik)
Die Implementierung einer umfassenden Dokumentation für die breite Palette an Methoden und Forschungsdaten, die aus der Forschung im SFB 1690 stammen, ist aufgrund der immensen Vielfalt an Metadaten eine bedeutende Aufgabe. Darüber hinaus erfordern Strategien für die klinische Translation eine weitere Standardisierung und Dokumentation, die die herkömmlichen Standards im Bereich der Neurowissenschaften übersteigt. INF ist bestrebt, eine Forschungsdatenplattform einzurichten und anzupassen, die den FAIR-Prinzipien entspricht. In enger Zusammenarbeit mit den Wissenschaftlern des SFB sollen die Reproduzierbarkeit und das Teilen von Daten gefördert und genau auf die spezifischen Bedürfnisse des SFB abgestimmt werden.
-
TP Z01: Zentrales Verwaltungsprojekt des SFBs
(Tobias Moser)

Dieses Projekt bietet allgemeine Unterstützung für die Arbeit im CRC 1690 – Unterstützung von Projekten in Verwaltungsangelegenheiten, Organisation von Workshops und Symposien, Unterstützung von Gastwissenschaftlern, Finanzplanung, Öffentlichkeitsarbeit, Pflege dieser Website und vieles mehr.
-
TP Z02: Maus-, Weißbüschelaffen- und Humanmodelle für Erkrankungen der sensorischen und motorischen Systeme
(Maria Patapia Zafeiriou / Nils Brose / Rüdiger Behr)
Es gibt verschiedene Modelle für die experimentelle und translationale neurowissenschaftliche Forschung, jedes mit spezifischen Vorteilen und Stärken. Im Projekt Z02 werden als Modellsysteme sowohl aus humanen induzierten pluripotenten Stammzellen abgeleitete Organoide als auch genetisch modifizierte Mäuse und genetisch modifizierte nichtmenschliche Primaten generiert. Indem wir uns die komplementären Stärken der drei Modelle zunutze machen, können wir die spezifischen Anforderungen der einzelnen wissenschaftlichen Projekte entsprechend dem Stand der Technik optimal erfüllen.
-
TP Z03: Entwicklung µLED-basierter implantierbarer optogenetischer Stimulatoren
(Patrick Ruther)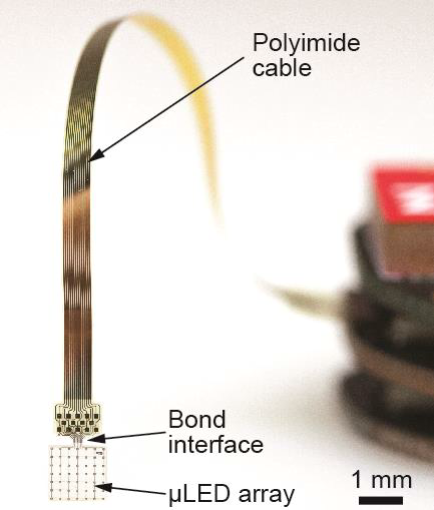
Wir wollen die nächste Generation präklinischer optogenetischer Stimulatoren entwickeln, validieren und anwenden. Diese basieren auf Dünnfilm-Leuchtdioden (μLEDs), die in mechanisch flexiblen Substraten integrierten sind. Hauptanwendungsszenarien sind schlanke, lineare µLED-Arrays für optische Cochlea- und kortikale Implantate, ein optischer Kehlkopfschrittmacher, sowie 2D-µLED-Arrays für in vitro Anwendungen. Die wesentlichen technologischen Ziele adressieren eine deutliche Verbesserung der µLED-Lichtextraktionseffizienz und Langzeitstabilität der Implantate unter physiologischen Einsatzbedingungen.